2. Общеизвестно, что примерно 71% земной поверхности покрыто океанами, в которых содержится около 96,5% всей воды на планете, или 1,4 × 1018 тонн. Остальная вода на поверхности сохраняется в полярных льдах, горных ледниках, в реках и озерах, а также в подземных источниках и резервуарах.
3. Гораздо менее известно, что такое же, если не большее количество воды находится глубоко в мантии Земли, причем в основном не в виде молекул H2O, а в кристаллической решетке номинально безводных мантийных минералов в виде дефектов, состоящих из ионов Н+ или ОН–.
4. Озеро Байкал — самый большой резервуар пресной воды на планете: 23 600 км3. Озеро Верхнее — наибольшее в системе Великих озер Северной Америки — в два раза уступает Байкалу по объему (11 600 км3), но зато в 2,5 раза больше Байкала по площади и является в этом смысле самым большим пресноводным озером на Земле.
5. Как и у большинства жидкостей, плотность воды при охлаждении увеличивается. Однако, в отличие от большинства жидкостей, плотность замерзшей воды — льда — меньше, чем плотность жидкой воды в равновесии с этим льдом. Такое аномальное поведение приводит к наличию максимума плотности воды при температуре около 4 оС, что чрезвычайно важно для жизни на Земле. Если бы вода была наиболее плотной при замерзании, то зимой озера и реки промерзали бы не от поверхности вглубь, а от дна к поверхности, при этом погибала бы вся плавучая живность.
6. Известно около 18 кристаллических модификаций льда — тоже своеобразный рекорд. Ученые до сих пор открывают всё новые твердые фазы Н2О и спорят об их точном числе. Некоторые из этих структур льда устойчивы только при очень высоких давлениях и не плавятся даже при 1000 оС, если давление превышает несколько сотен тысяч атмосфер.
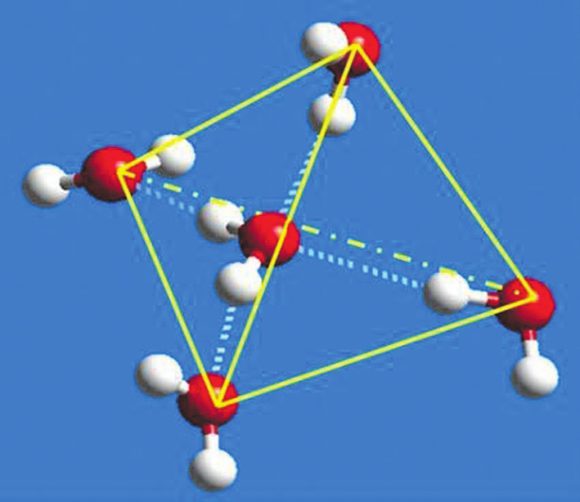
7. Многие аномальные свойства воды объясняются наличием водородных связей между ее молекулами. Структура отдельной молекулы воды — Н2О — довольно проста: вследствие гибридизации молекулярных орбиталей две составляющие ее О—Н связи (каждая — длиной около 0,1 нанометра) расположены друг к другу под углом примерно 104°. Близость этого угла к тетраэдрическому (109,5°) и характерное неравномерное распределение электронной плотности внутри молекул Н2О позволяет им легко образовывать водородные связи (Н-связи) со своими четырьмя ближайшими соседями. Атомы водорода выступают при этом донорами, а атом кислорода служит акцептором в среднем двух таких связей. Молекулы воды, связанные такими сетками Н-связей, образуют трехмерные структуры, представляющие собой более или менее крупные фрагменты локально упорядоченной алмазоподобной тетраэдрической кристаллической решетки (см. рис.). В кристалле обычного льда такая решетка близка к идеальной, а в жидкой воде при нормальных условиях структура этих небольших тетраэдрических молекулярных кластеров может быть искажена и быстро меняется со временем.
8. Энергия даже самых сильных водородных О···Н связей между молекулами в 10 раз слабее энергии составляющих отдельную молекулу ковалентных О—Н связей, поэтому трехмерная сетка Н-связей в воде постоянно разрывается и реорганизуется в новые похожие структуры просто в результате теплового движения молекул. Время жизни одной Н-связи очень коротко — всего порядка пикосекунды (10–12 с). Таким образом, об особой структуре воды и о «памяти воды» можно говорить, только имея в виду их крайнюю недолговечность.
9. С другой стороны, энергия водородных связей между молекулами Н2О гораздо выше энергии обычных межмолекулярных взаимодействий. Это приводит к так называемому гидрофобному эффекту, когда молекулы, которые слабо взаимодействуют с водой, склонны собираться вместе, минимизируя таким образом поверхность контакта (капельки масла в воде) и давая возможность молекулам Н2О создавать наибольшее количество Н-связей.
10. Внутримолекулярные и межмолекулярные водородные связи и гидрофобный эффект обеспечивают также особые структуру и функции трех важнейших типов макромолекул в живой природе: протеинов, нуклеиновых кислот и углеводов. Так, двойная спиральная структура молекулы ДНК чрезвычайно устойчиво сохраняется благодаря водородным связям между отдельными комплементарными нуклеотидами — элементами структуры ДНК, где в качестве акцептора Н-связи выступают не только атомы кислорода, но и атомы азота.
Андрей Калиничев
