

Продолжение беседы главного редактора ТрВ-Наука Бориса Штерна с биологом Михаилом Никитиным, науч. сотр. отдела эволюционной биохимии НИИ физико-химической биологии им. Белозерского при МГУ, автором книги «Происхождение жизни: от туманности до клетки» (М.: Альпина нон-фикшн, 2016). Видеозапись интервью — youtu.be/VlUa7fk2Pfw. См. также предыдущие публикации в ТрВ-Наука: trv-science.ru/2024/01/alternativnye-formy-zhizni/ и trv-science.ru/tag/proisxozhdenie-zhizni.
— Здравствуйте! Сегодня у нас опять — надеюсь, не в последний раз — Михаил Никитин. Сегодня будем говорить о втором таком интересном этапе эволюции. В прошлых выпусках мы говорили с Евгением Куниным1 и с Александром Марковым 2 о том, как появился первый репликатор — то есть современные воззрения на то, что такое жизнь, определение начала самой жизни — это появление репликатора, который участвует в дарвиновской эволюции, у которого есть наследственность, изменчивость и отбор. Все сходятся на том, что первым репликатором была молекула РНК, что всё началось с РНК-мира. Но вот если бы всё им и закончилось, то это ведь было бы неинтересно. Ну, хорошо, плавают где-то там в каком-то растворе — совершенном РНК-мире — совершенные молекулы РНК, которые великолепно умеют размножаться и отлично проходят отбор. Ну и что дальше? Это раствор. Жизнь-то стала двигаться дальше, когда она обросла белками и у нее появились инструменты и тело — это всё белки уже. Сегодня, скорее всего, четких ответов на то, как это произошло, нет, но хотя бы порассуждать на эту тему с Михаилом Никитиным мы попробуем.
— Здравствуйте, Борис. Спасибо, что позвали меня еще раз. Надеюсь, что не в последний. Но, конечно, после Евгения Кунина мне довольно сложно о чем-то с ним спорить, хотя поспорить местами хочется. И немножко уточню ваши слова. На самом деле, конечно, в науке о происхождении жизни нет полного консенсуса о том, что первый репликатор представлял из себя молекулу РНК. Есть гипотезы о ксенонуклеиновых кислотах — т. е. о каких-то других полимерах, способных к образованию двойной спирали, переносу генетической информации, и более стабильных, чем РНК. Есть гипотезы о протометаболических циклах, есть гипотезы (хотя очень слабо подтвержденные) о системах реплицирующихся пептидов. Теория мира РНК — наиболее принятая, но полной общепринятости теорий в науках, изучающих события прошлого, как вы можете знать на примере космологии, наверное, не бывает.
— Есть хотя бы и не полная, но «сильная» общепринятость по поводу теории космологической инфляции.
Да, есть сильная общепринятость, что теория мира РНК имеет много недостатков, но она лучшая из худших теорий о первом репликаторе. Действительно, от первого репликатора до всепланетной биосферы, хотя бы микробной, прошло очень много эволюционных шагов, и важнейшим из них было приобретение кодируемого белкового синтеза — способности создавать белки произвольной последовательности, закодированные в молекулах РНК и впоследствии ДНК. Система, которая занимается синтезом белка в живых клетках — это одна из самых сложных молекулярных машин, и при этом она самая универсальная. Рибосомы есть так или иначе во всех клетках.
Типичная рибосома состоит из трех (у бактерий) или четырех (в случае эукариот) молекул РНК и из нескольких десятков белковых молекул, которых может быть до 80. То есть это такая довольно большая и сложная молекулярная машина. Довольно трудно было бы представить, как такая машина может возникнуть путем дарвиновской эволюции пошагово, т. е. путем накопления последовательных мутаций: большинство из деталей рибосомы нельзя выкинуть, не поломав ее главную функциональность — кодируемый синтез белков. Но по мере накопления фактов, по мере изучения разнообразия рибосом, по мере изучения некоторых других биологических процессов стало понятно, что рибосома могла возникнуть эволюционным путем — путем смены функций, так же, как и другие сложные биологические системы.
Ну вот, например, крыло птиц — это сложная система, оптимизированная для полета, и упрощенные ее версии для полета не подходят. Но происхождение птичьего крыла для нас не представляет большой сложности, потому что мы знаем, что это переделанные передние конечности других наземных позвоночных — рептилий, до того амфибий, а до того рыб. И вообще, парные конечности позвоночных возникли как плавники каких-то древних рыбообразных существ, которые потом много раз меняли функции. Вот и с рибосомой, и с отдельными ее компонентами и вспомогательными системами, работающими вокруг, тоже накоплено достаточно свидетельств того, что их эволюция происходила через смену функций.
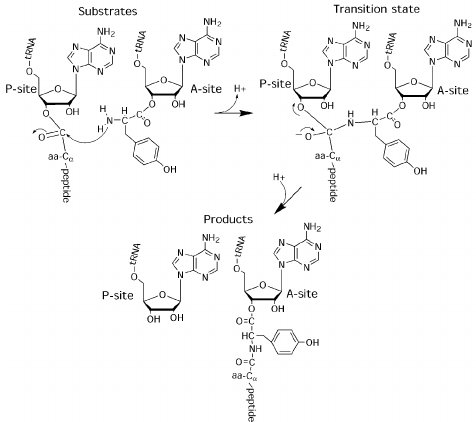
Значит, во-первых, рибосома состоит из двух химических компонент: из РНК нуклеиновой кислоты и из рибосомных белков. Что делает рибосома, если разбираться конкретно? Основная химическая реакция, которую катализирует рибосома, — это пептидилтрансферазная реакция, т. е. перенос пептидной цепочки растущего белка на молекулу следующей аминокислоты. При этом происходит удлинение цепочки на одну аминокислоту. Эта реакция происходит в пептидилтрансферазном центре рибосомы, и из изучения структуры рибосом видно, что никаких рибосомных белков в пептидилтрансферазном центре нет. Он образован только рибосомной РНК, и механизм катализа в нем обеспечивается только РНК. То есть рибосома — это самый главный, самый важный рибозим, присутствующий в любой живой клетке. Это указывает на принципиальную возможность работы рибосомы в какой-то древней, примитивной, вообще без белков среде. Так что парадокс курицы и яйца у нас на этом месте не возникает: для синтеза первых белков не обязательно уже иметь готовые белки. Голая РНК с этим может справиться.

Если посмотреть на рибосомную РНК как на такой трехмерный пазл (см. рис.), то цепочка РНК складывается в клубок, представляющий из себя основу субъединицы рибосомы за счет нескольких типов взаимодействий. Во-первых, за счет уотсон-криковских пар между азотистыми основаниями, приводящих к образованию коротеньких двуспиральных участков-шпилек. Это двуспиральные фрагменты одной нити, сложенной пополам, т. е. с одной стороны эта двойная спираль заканчивается петлей. Следующий механизм — это солевые мостики, разные положительно заряженные ионы в разных местах рибосомы. Это могут быть как неорганические ионы (магний, калий и цинк), так и простые органические полиамины, а также сложные положительно заряженные ионы, т. е. молекулы рибосомных белков. Рибосомные белки как раз положительно заряжены — в отличие от типичных белков — большинства белков клетки. Это позволяет им компенсировать отрицательный заряд рибосомной РНК. Вот эти вот положительно заряженные противоионы позволяют отрицательно заряженной РНК преодолеть электростатическое отталкивание разных частей молекул друг от друга и свернуться компактно.
Дальше есть более тонкие и сложные взаимодействия, помогающие ей свернуться, например так называемые а-минорные контакты. Это водородные связи, которые образуются между аминогруппами аденинов одного участка РНК и гидроксильными группами рибозы другого участка РНК. При этом тот участок, который дает рибозу для этой связи, — двуспиральный, а тот участок, который дает аденины, — односпиральный. Сравнение рибосом близких видов бактерий и опыты по искусственному мутагенезу (по внесению ошибок в последовательности рибосомной РНК показывают: если этот а-минорный контакт нарушить, сломать, например заменив аденин на другое азотистое основание, то от этого страдает укладка адениновой стороны контакта, а укладка двуспиральной стороны контакта не страдает.
То есть это такой несимметричный контакт, который важен для стабильности одной своей стороны, но не важен для другой, для двуспиральной. Поэтому а-минорные контакты позволяют нам наложить на структуру рибосомы ось времени — оценить сравнительный возраст разных ее частей — какие части рибосомной РНК возникли раньше, какие позже: из-за такой несимметричности а-минорных контактов их двуспиральные стороны, скорее всего, старше, чем адениновые. И такой анализ показывает, что, действительно, самая древняя часть рибосомы — это пептидилтрансферазный центр, т. е. именно та часть рибосомы, которая удлиняет белковую цепочку. Пептидилтрансферазный центр находится на большой субъединице рибосомы. В большой субъединице рибосомы есть две или три молекулы РНК, в малой субъединице рибосомы есть одна молекула РНК.
Пептидилтрансферазный центр
Главный каталитический центр рибосомы, осуществляющий синтез пептидных связей. Участок большой субъединицы рибосомы, связывающий транспортную РНК.
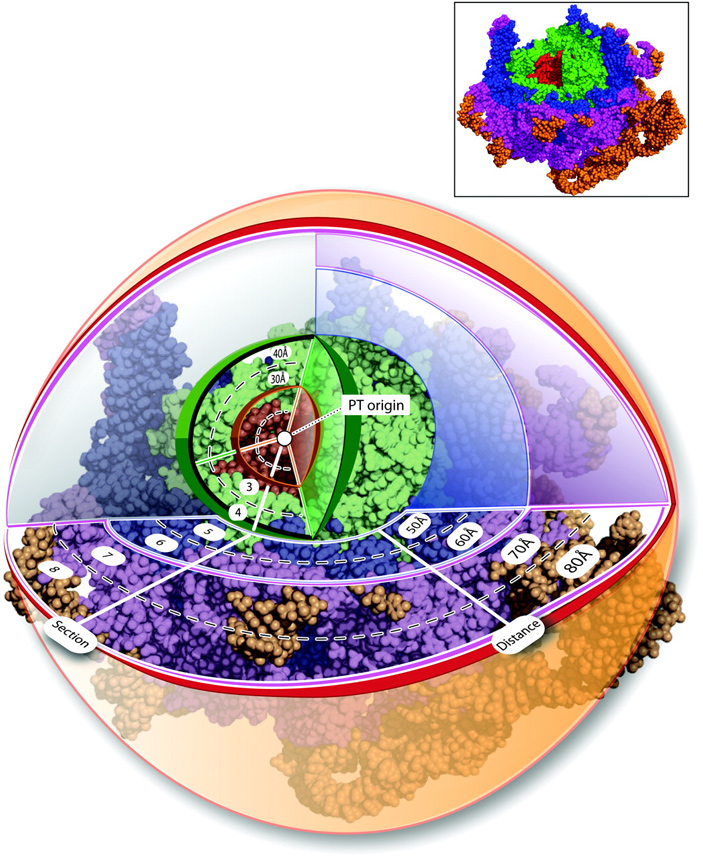
Так вот, что важно? Важно то, что с генетическим кодом, с матричной РНК работает малая субъединица рибосомы и декодирующий центр рибосомы, который всем этим занимается: он находится пространственно далеко (на расстоянии порядка 10 нм) от пептидилтрансферазного центра. Прямого контакта между ними нет. Транспортные РНК (такие маленькие РНК-носители, которые приносят новую аминокислоты в рибосому) одним концом входят в пептидилтрансферазный центр, другим — в декодирующий. И это единственное, что связывает пептидилтрансферазный центр с декодирующим в процессе работы рибосомы. И если смотреть по а-минорным контактам, то те участки большой субъединицы рибосомы, которые контактируют с малой, моложе, чем пептидилтрансферазный центр. Если также смотреть направленные а-минорные контакты в малой субъединице рибосомы, то там тоже декодирующий центр — это самая древняя часть, а участки контакта с большой субъединицей моложе.
И по этим данным получается, что пептидилтрансферазный центр и декодирующий центр имели какую-то свою независимую историю до того, как собрались вместе, образовав рибосому. И давайте подумаем, что они могут делать по отдельности. Современную функцию рибосомы — кодируемый синтез белков — они по отдельности выполнять, конечно, не могут. Пептидилтрансферазный центр может соединять аминокислоты в цепочку, но инструментов для контроля их последовательности в цепочке у него нет. Поэтому если ему подавать все 20 аминокислот, входящих в состав современных белков, то на выходе будет получаться какая-то случайная белковая последовательность, которая вряд ли будет функциональной, и, что еще важнее, даже если она будет полезна клетке, если этот белок будет делать что-то нужное, то его не получится повторить вновь: вероятность его повторного получения будет ничтожно малой. Так, кодируемый синтез белков тут невозможен. Что же тогда полезного может сделать пептидилтрансферазный центр, который не может заниматься кодируемым белковым синтезом?
Что в простейшем случае он может сделать такого полезного и воспроизводимого? Самое простое — это гомополимерные пептиды, т. е. пептиды, состоящие из одной аминокислоты, повторенной много раз, например полиаланин или полиглицин. Но полезных функций у таких пептидов мне, к сожалению, не удалось найти по всей научной литературе. Еще такая система может производить стохастические пептиды из смеси двух-трех аминокислот. За счет уменьшения аминокислотного алфавита с 20 до двух или трех мы получаем воспроизводимость пептидов. Могут ли такие пептиды быть полезными? Могут. Про это расскажу чуть позже. И третий вариант более сложный — это пептидилтрансферазный центр, который, в принципе, мог бы с некоторыми дополнительными, несложными механизмами делать периодические пептиды — те пептиды, в которых аминокислоты чередуются каким-то регулярным образом, например АБАБАБ. Это простые пептиды, воспроизводимые пептиды, и для них есть потенциал, что они могут делать полезного.
Теперь вопрос: что полезного могут делать для развивающегося РНК-мира простые пептиды, будь они периодическими или случайными? Все белки, взаимодействующие с РНК (а в мире РНК первые белки, несомненно, должны были с ней взаимодействовать), несут положительный электрический заряд, компенсирующий отрицательный заряд РНК. Это позволяет им электростатически притягиваться. Таковы все рибосомные белки, таковы многие другие белки, взаимодействующие с РНК. И в экспериментах показано, что активность и стабильность практически любых рибозимов очень сильно повышается, если им добавить такие положительно заряженные белки. Более того, не обязательно даже добавлять белки. Работают даже гомополимерные пептиды, например пептид, состоящий из десяти остатков аминокислоты лизина — одной из двух аминокислот с положительным зарядом. Он повышает активность многих рибозимов в десятки и сотни раз. Или пептид, в котором остатки лизина случайным образом перемешаны с остатками глицина. Незаряженные аминокислоты тоже так работают.
Довольно близки к этому такие пептиды, как TAT-пептид вируса иммунодефицита человека. Это фрагмент одного из белков ВИЧ, который принимает участие в процессинге РНК этого вируса. Если этот короткий 9-аминокислотный пептид химически синтезировать отдельно от вируса, он тоже помогает стабилизации самых разных рибозимов в пробирке. Он тоже положительно заряжен. То есть если у нас есть положительно заряженные аминокислоты, то с их помощью любой пептид, будь то с правильным чередованием, будь то случайный, может быть полезен миру РНК. И вот это уже выглядит как хорошая такая функция для проторибосомы, для отдельного пептидилтрансферазного центра. Были эксперименты, когда рибосомную РНК большой субъединицы (а она длинная, более 3 тыс. нуклеотидов) пытались сильно укоротить и посмотреть, сохранится ли пептидилтрансферазная активность. Оказалось, что ее можно сократить почти в шесть раз, примерно до 600 нуклеотидов, и пептидилтрансферазная активность сохраняется.
Более того, есть еще более короткие варианты, вплоть до 150 нуклеотидов, которые частично сохраняют слабую пептидилтрансферазную активность, если им давать аминокислоты на носителе — на транспортной РНК. То есть проторибосома могла быть во много раз проще современной рибосомы.
Она могла быть не просто безбелковой: еще ее РНК могла быть гораздо короче в пределах длины известных экспериментально полученных рибозимов, каталитических РНК. Если у нас есть положительно заряженные аминокислоты, то, чередуя их с каким-нибудь простым глицином и аланином, мы можем сделать пептиды, весьма полезные для самых разных рибозимов.
Не сохранилось ли что-то подобное в клетке сейчас? Если посмотреть на структуру рибосомных белков, то несколько из них — это белки большой субъединицы L2, L3, L4 и L22, которые глубже всего входят в большую субъединицу. У них есть довольно длинные участки почти такой же структуры. В них нет ни альфа-спиралей, ни бета-слоев, характерных для типичных белков, которые сворачиваются в компактный клубок. Это не клубки, а такие ленты, вставленные в узкие щели в клубке РНК, несущие большой положительный заряд. Они богаты положительно заряженными аминокислотами, лизином и аргинином, и почти на две трети состоят из этих двух заряженных аминокислот, чередуемых с самыми простыми аминокислотами — с глицином, аланином и пролином. Таким образом, их аминокислотный состав очень сильно перекошен по сравнению со средними клеточными белками.
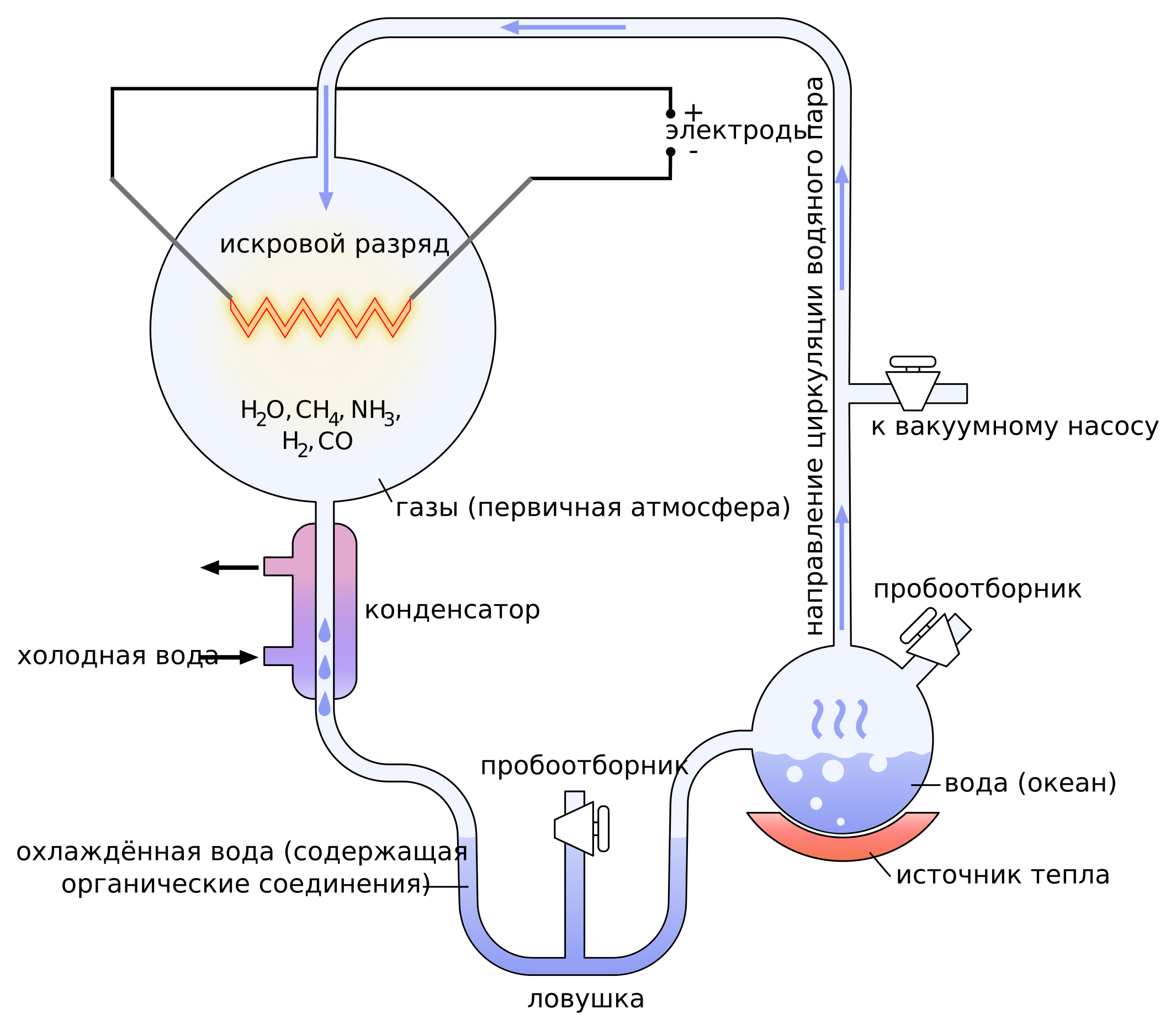
Тут есть некоторая сложность, связанная с химией лизина и аргинина. Эти две современные положительно заряженные аминокислоты, во-первых, довольно сложные: у них длинные и сложные пути биосинтеза (у аргинина восемь стадий, а у лизина — девять), и они не обнаруживаются в разных опытах по абиогенному синтезу аминокислот, начиная с опыта Миллера (см. врезку). Но и в опыте Миллера, и в метеоритной органике встречаются более короткие и простые положительно заряженные аминокислоты, такие как орнитин, диаминомасляная и диаминопропионовая. Более того, эти короткие положительно заряженные аминокислоты есть даже в живых клетках. Орнитин есть у всех организмов как предшественник аргинина в биосинтезе; диаминопропионовая и диаминомасляная бывают у микробов в составе некоторых пептидных антибиотиков.

Эксперимент Миллера — Юри
Первый эксперимент по синтезу аминокислот из неорганических молекул. Через пары воды в присутствии метана, аммиака водорода и угарного газа пропускались электрические разряды, что имитировало молнии в древней атмосфере Земли. В результате был получен набор аминокислот.
Получается, жизнь имела возможность попробовать эти коротенькие положительно заряженные аминокислоты в составе белков, но почему-то их там не выбрала. Моя гипотеза здесь состоит в том, что на самом деле они входили в состав древних белков, но были вытеснены впоследствии более длинными и сложными лизином и аргинином, потому что вот эти короткие положительно заряженные аминокислоты не вписываются в альфа-спиральную укладку белка. То есть альфа-спираль ломается при попытке встроить в нее эти коротенькие положительно заряженные аминокислоты. Их положительный заряд нарушает водородные связи, скрепляющие альфа-спираль. При этом с бето-слоевыми структурами они совместимы. И, конечно, они полностью совместимы с неструктурированными белками, такими, как вот эти глубокие рибосомные белки. И синтетические пептиды с этими аминокислотами прекрасно помогают рибозимам ничуть не хуже, чем с лизином и аргинином.
Тут я предполагаю, что было вымирание некоторых аминокислот в белковом алфавите и замена их другими, более сложными, — лизином и аргинином. Эти древние положительно заряженные пептиды могли быть первым продуктом проторибосомы, который поддерживался естественным отбором.
— А теперь давайте я попробую изложить то, что понял, а вы меня проконтролируете. Зачем понадобились коротенькие положительно заряженные аминокислоты? Для компенсации: РНК стала продуцировать коротенькие пептиды ради того, чтобы скомпенсировать свой отрицательный заряд. И таким образом у них появилась как бы большая степень свободы. Правильно я понял вот это самое начало?
— Появилась возможность компактно сворачивать более крупные, более сложные молекулы РНК.
— Хорошо. Дальше вот эти самые первые пептиды оказались неудобными, потому что они как бы не вписывались в какие-то более сложные структуры белков, и поэтому эволюционно они в конце концов заменились на другие, может быть, менее заряженные, но, так скажем, более удобные. Правильно ли я это понял?
— Электрический заряд там и там единичный, одна аминогруппа — и у лизина, и у аргинина, и у их древних аналогов, просто у лизина и аргинина она вынесена дальше от остова пептидной цепи, на более длинной боковой веточке. Она отодвинута подальше.
— Спасибо, немножко вернулись, и чего-то вроде начало доходить. Теперь давайте дальше.
— Ну, главная идея — про то, что некодируемый синтез пептидов мог быть функцией проторибосомы без малой субъединицы. Проторибосома могла из какого-то очень простого аминокислотного набора, в две-три, может быть, даже в одну аминокислоту, собирать либо периодические, либо случайные пептиды, которые были поддержаны естественным отбором, потому что они были положительно заряжены, и это помогало рибозимам. Это их стабилизировало и активировало.

Как теперь от этого перейти к кодируемому белковому синтезу? Для этого надо, во-первых, чтобы появилась малая субъединица рибосомы и правильно соединилась с большой, а для этого нужны адаптеры, т. е. молекулы транспортных РНК, которые являются такими главными молекулярными мостами между последовательностью нуклеиновой кислоты и последовательностью белка. Рибосому можно обмануть, если подсунуть ей аминокислоту на не своей, не соответствующей ей транспортной РНК. Рибосома тогда сделает неправильный белок; у нее нет никаких средств эту ошибку заметить и тем более исправить. А вот у транспортной РНК-адаптера, с одной стороны, есть так называемая антикодоновая петля, в которой есть антикодон, три нуклеотида, комплементарные трем нуклеотидам в матричной РНК, кодирующим ту самую аминокислоту (см. схему вторичной структуры тРНК). И, с другой стороны, у нее есть акцепторный стебель, на который присоединяется аминокислота. В современном мире правильное соединение аминокислот — это работа семейства из 20 ферментов аминоацил-ТРНК-синтаз. Их 20 — по одному на каждую аминокислоту — каждый опознает соответствующие этой аминокислоте транспортные РНК. (Транспортных РНК на самом деле больше 20, их порядка 40 или 50 у разных организмов, потому что кодонов в генетическом коде всего 64, из них 61 кодируют те или иные аминокислоты.) Поэтому для опознания всех кодонов нужно больше 20 вариантов антикодонов. Точность, соответствие аминокислоты и транспортной РНК, проверяет только аминоацил-ТРНК-синтаза.
Откуда вообще возьмется соответствие между 20 типами транспортных РНК с 20 или более типами антикодонов и 20 аминокислотами? Для работы пептидилтрансферазного центра даже в контексте некодированного белкового синтеза аминокислоты должны быть несвободными, они должны быть прикреплены к какому-то РНК-носителю, аналогично транспортной РНК. Полноценная транспортная РНК — молекула в виде трилистника из трех шпилек и двуспирального участка, заканчивающегося акцепторным стеблем без петли, — для этого не обязательна. Можно сократить транспортную РНК до одной шпильки, до одного двуспирального участка. Если у нее акцепторный стебель всё еще такой же, как у транспортной РНК, то пептидилтрансферазный центр может ее принять и может использовать для сборки пептида. То есть у транспортных РНК могли быть более короткие и более простые предшественники.
Вот тут есть очень сложное место, которое я не уверен, что смогу кратко и понятно объяснить. На тему возможного соответствия аминокислот и их кодонов за десятки лет — с момента открытия генетического кода — сломано было очень много копий, и очень много крупных ученых приложило к этому руку. И количество противоречивых гипотез там просто чудовищно. Значит, самое простое, что напрашивается: есть какое-то соответствие по форме молекулы между аминокислотой и ее кодоном.
Эта гипотеза имеет несколько недостатков. Во-первых, кодон — больше, чем аминокислота. Кодон — это три нуклеотида, это по длине цепочки в шесть раз больше, чем одно аминокислотное звено в белке. Хотя, конечно, никто не может запретить взаимодействие аминокислот с кодонами, но если у нас есть две аминокислоты, взаимодействующие с двумя соседними кодонами, то они будут слишком далеко, чтобы их можно было связать.
Во-вторых, когда пытались экспериментально это проверить, делая РНК, отобранные на связывании различных аминокислот (так называемые РНК-аптамеры), были получены РНК-аптамеры, которые хорошо связывают аминокислоты с крупными и сложными молекулами (такие, как аргинин, лейцин или фенилаланин), но не получилось хороших аптамеров для самых простых аминокислот, таких как глицин и аланин. А на заре пептидного синтеза, несомненно, глицин и аланин были среди самых древних. Вот этот аптамерный механизм прямого взаимодействия аминокислоты с кодоном явно, если и поучаствовал, то не с самого начала развития генетического кода и не для всех аминокислот. Возможно, он даже и практически не сыграл роли.
Что мне здесь нравится больше? Посмотрим на то, как аминоацил-тРНК-синтетазы узнают транспортные РНК. Рибосома узнает транспортные РНК по их антикодоновой петле. Но аминоацил-тРНК-синтазы антикодоновую петлю, как правило, не проверяют. Большинство аминоацил-тРНК-синтаз, в том числе все аминоацил-тРНК-синтазы для древних и простых аминокислот, включая глицин, аланин, пролин и аспартат, проверяют только акцепторный стебель — только ту часть молекулы транспортной РНК, к которой они будут присоединять аминокислоту. Что тут можно заметить? Разные транспортные РНК они узнают по последовательности нуклеотидов акцепторного стебля, и в первую очередь по трем первым парам нуклеотидов этого акцепторного стебля. Эти три первые пары нуклеотидов называются рабочим кодом — operational code в англоязычной литературе.
И вот тут есть забавное совпадение, что именно для древних аминокислот — для глицина, аланина, аспартата, валина и пролина — рабочий код совпадает с одним из кодонов для этой аминокислоты. Для других аминокислот не совпадает, а для древних и простых совпадает. Случайно ли это? Мне кажется, что нет. Более того, если посмотреть на структуру современных транспортных РНК, в них видны некоторые тенденции к внутренним повторам: транспортную РНК можно собрать путем дупликации двух одинаковых более коротких шпилек. И при такой сборке путем дупликации антикодоновая петля возникает именно как копия рабочего кода. То есть если происходила внутренняя дупликация прототранспортных РНК, то первые антикодоновые петли были копиями первых рабочих кодов. И рабочий код для глицина, аланина, пролина и еще там пары аминокислот до сих пор это отражает, совпадая с их кодонами и не совпадая в случае других более поздних аминокислот. Таким образом, если в какой-то момент произошла дупликация в РНК-носителях аминокислот, предшественников транспортных РНК, наделившая их антикодоновыми петлями — копиями рабочего кода, — то эти антикодоновые петли могли образовывать комплементарное взаимодействие с каким-нибудь торчащим концом рибосомной РНК, древней проторибосомы и за счет этого обеспечивать какое-то более сложное или более воспроизводимое чередование аминокислот. Но для этой проторибосомы последовательность ее белкового продукта была жестко в ней самой зафиксирована, в последовательности ее собственной рибосомной РНК, — это некоторый шаг к коду, но это еще не код. Кодом он стал, когда появилась отдельная сменная матричная РНК, взаимодействующая с антикодоновыми петлями, и малая субъединица, которая это взаимодействие организует.
Откуда могла появиться малая субъединица? Она, строго говоря, не катализирует никаких химических реакций, но что происходит в ее декодирующем центре? Там происходит взаимодействие антикодоновой петли транспортной РНК и кодонов матричной РНК — три нуклеотида с одной стороны, три нуклеотида с другой стороны. Она контролирует, чтобы там было точное комплементарное совпадение на каждом шаге белкового синтеза. А между шагами малая субъединица обеспечивает продвижение всей системы на три нуклеотида вдоль матричной РНК, переходя на следующий кодон, выбрасывая использованную транспортную РНК и предоставляя место для входа следующей транспортной РНК, несущей следующую аминокислоту. Какие другие, не связанные с белковым синтезом процессы, это напоминает? Взаимодействие двух цепочек РНК и проверку их комплементарности. Это близко к тому, что происходит в системе копирования РНК, например в зависимых РНК-полимеразах. Не исключено, что малая субъединица РНК — это потомок того самого рибозима, который мечтали воскресить все ученые, занимавшиеся искусственным отбором рибозимов. Рибозима — РНК-зависимой РНК-полимеразы. Только, судя по тому, что он двигается шагами по три, он присоединял нуклеотиды к растущей цепочке не по одному, как белковые РНК-полимеразы, а сразу триплетами, тройками — рибозим трипликаза. Насколько мне известно, первым эту гипотезу предложили у нас в 1980-е годы на кафедре вирусологии3, но тогда ей не было уделено внимания, она была опубликована только на русском языке в не самом известном журнале и была бы потеряна, если бы Евгений Кунин, учившийся на той же кафедре, не запомнил это и не упомянул впоследствии в своих работах, уже будучи знаменитым ученым с гигантским списком публикаций.
Вполне возможно, что малая субъединица рибосомы — это потомок того самого главного рибозима, который копировал все остальные рибозимы в мире РНК до появления белков. У нее была своя интересная трудовая биография до вхождения в состав рибосомы — ничуть не проще, чем у пептидилтрансферазного центра, делавшего случайные или периодические пептиды. На этом месте можно уже говорить о переходе от проторибосомы к рибосоме и о появлении генетического кода и синтеза произвольных белков, но, конечно, в рамках доступного аминокислотного алфавита. Скорее всего, на этом этапе аминокислотный алфавит был гораздо меньше современного.
Какие аминокислоты туда могли входить? Туда заведомо могли входить самые простенькие — глицин, аланин, пролин, что-то положительно заряженное, ну и, наверное, еще аспартат и валин, для которых тоже есть совпадение рабочего кода с антикодоновой петлей. В минимальном варианте кодируемый синтез белков мог начаться всего с шести аминокислот. На самом деле, это не так уж мало. В этом наборе есть вымершая аминокислота с положительным зарядом, аминокислота с отрицательным зарядом (аспартат), аминокислота гидрофобная (валин), аминокислота без особых примет (аланин), аминокислота гибкая (глицин). По глицинам белковая цепочка гнется гораздо лучше, чем по другим аминокислотам. И есть аминокислота жесткая (пролин), которая, наоборот, образует неразгибаемые повороты. Получается, для трехмерной укладки белков вся принципиально важная функциональность на этом этапе уже есть. Из такого набора уже можно построить белки, способные свернуться в клубок самостоятельно, а не помогать сворачиванию РНК. Среди них уже могут быть какие-то ферменты, какие-то белки с каталитической активностью, в первую очередь за счет того, что остатки аспартата (аспарагиновой кислоты) будут связывать разные катионы металлов — магний, калий, кальций, цинк и т. д.
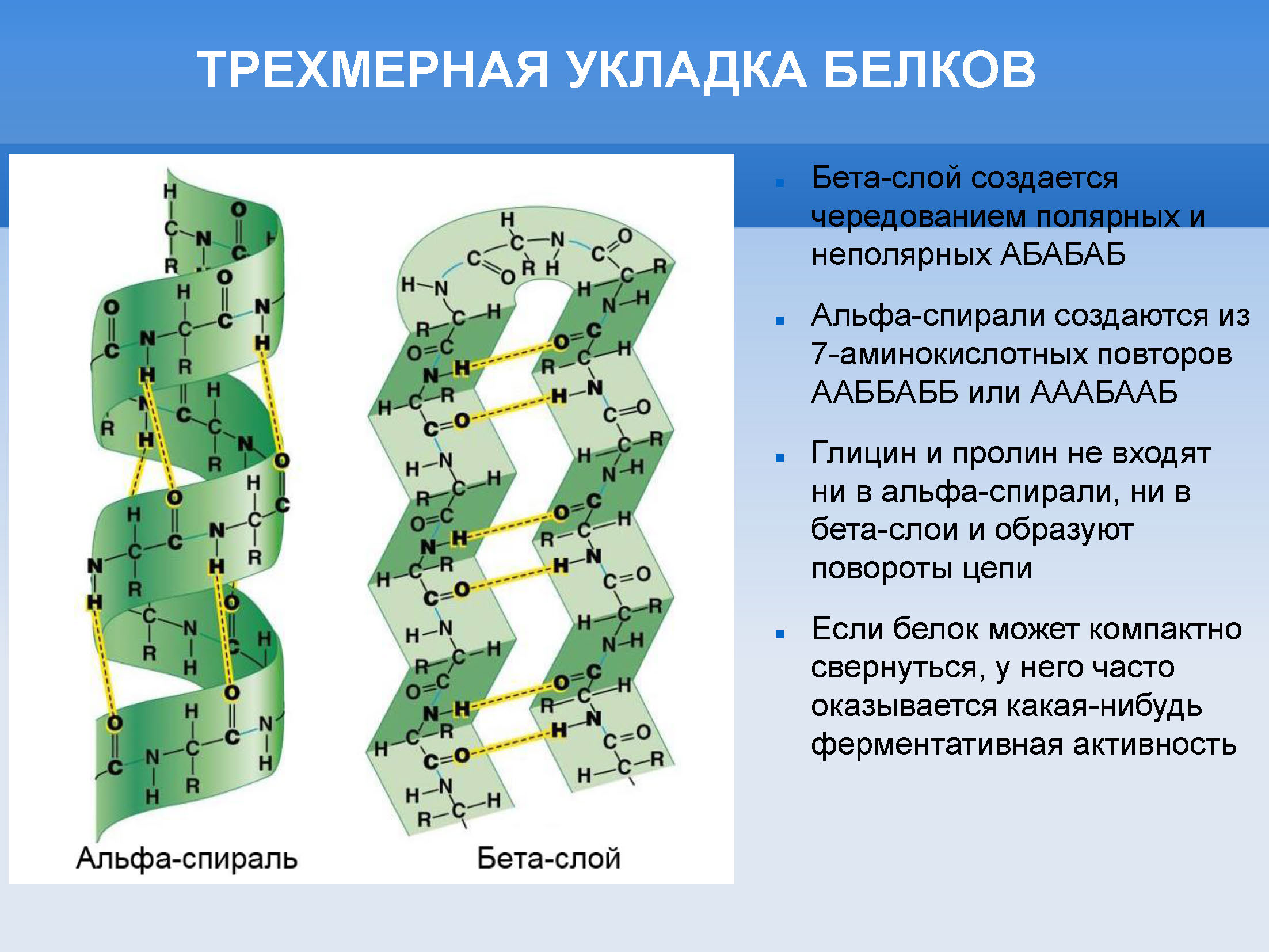
Дальше, скорее всего, расширение аминокислотного алфавита шло по нескольким линиям. Во-первых, туда добавлялись другие аминокислоты, важные для ферментативного катализа, — гистидин, серин и цистеин. Гистидин с имидазольной группой — это кислотно-основной катализ. Цистеин — серосодержащая аминокислота, т. е. связывание железа, меди, цинка и окислительно-восстановительной реакции через дисульфидные мостики. Серин — это аминокислота с спиртовой группой, тоже для кислотно-основного катализа. Дальше добавлялись ароматические аминокислоты — фенилаланин, тирозин, триптофан. Во-первых, они объемные, а во-вторых, фенилаланин — самая объемная из гидрофобных, обеспечивающая образование плотного стабильного гидрофобного ядра у белкового клубка, у белковой глобулы. Они же за счет стэкинг-взаимодействия позволяют лучше связываться белкам с нуклеиновыми кислотами и нуклеотидами. Кроме того, триптофан поглощает ближний ультрафиолет, и в некоторых ферментах он участвует в фотокатализе, например в фотолиазе, чинящим повреждения в ДНК. Какие аминокислоты нам еще необходимы до современного 20-аминокислотного набора? Во-первых, более длинные, положительно заряженные — лизин и аргинин; длинные, отрицательно заряженные — глутамат; длинные гидрофобные — лейцин и изолейцин. Всё это лучше вписывается в альфа-спиральные белковые укладки, чем древние аминокислоты (см. схему трехмерной укладки белков).
Если смотреть по рибосомным белкам, то самые древние из них имеют бета-слоевую укладку, а молодые, находящиеся на поверхности рибосомы, включают в себя всё больше и больше альфа-спиралей. То есть альфа-спиральная укладка, вероятно, эволюционно моложе, чем бета-слои. Чем она принципиально лучше бета-слоев? Сложно придумать, конечно, такое универсальное преимущество, но, мне кажется, таким могла быть устойчивость к кристаллизации. Бета-слоевая укладка довольно сильно упорядочена, и белки с бета-слоевой укладкой гораздо легче кристаллизуются. В том числе это может вызывать проблемы, например при кристаллизации бета-слоевого амилоидного белка при нейродегенеративных заболеваниях. Когда у вас 50 белков, то вероятность того, что какой-то из них будет выпадать в осадок, в кристаллы, не очень велика, а когда у вас тысяча белков, эта вероятность уже становится заметной. И альфа-спиральные укладки в этом плане безопаснее. Поэтому эволюция, конечно, благоприятствовала им, как благоприятствовала и введению в аминокислотный алфавит новых аминокислот, которые нужны для стабильности альфа-спирали, — глутамат, лизин, аргинин, лейцин, изолейцин.
И есть две аминокислоты, которые, с одной стороны, химически не очень сложные, а с другой, скорее всего, стали последними в генетическом алфавите. Это амиды — аспарагин и глутамин, производные аспартата и глутамата. Они полярные, имеют амидную группу, не имеют электрического заряда. Почему они, скорее всего, последние в аминокислотном алфавите? Потому что не очень устойчивы к высоким температурам. У гипертермофильных микробов в белках почти нет этих аминокислот, потому что при высоких температурах они могут спонтанно дезаминироваться и превращаться в своих кислых предшественников — аспартат и глутамат — с появлением электрического заряда. А появление электрического заряда в белковой молекуле, там, где его раньше не было, — это отличный способ поломать белковую укладку, но также и обратное — убрать электрический заряд там, где он был. Серповидно-клеточная анемия — пример такого заболевания. При этой мутации аспарагиновая кислота, заряженная, в гемоглобине меняется на валин в одном месте — и всё, и такой гемоглобин начинает кристаллизоваться и хуже переносить кислород. Вот эти нетермостойкие аминокислоты — аспарагин и глутамин — скорее всего, последние в аминокислотном наборе, потому что есть основания считать, что жизнь делала первые шаги в горячих источниках того или иного типа при достаточно высоких температурах. На ту глубину в прошлое, на которую мы можем заглянуть сравнительной геномикой, общий предок бактерий и архей — LUCA (Last Universal Common Ancestor), возрожденные его белки (когда последовательность этого белка восстанавливают методами максимального правдоподобия по белкам его потомков, потом эту возрожденную последовательность воспроизводят химически, в плазмиде, в кишечной палочке, изучают наработанный таким образом воскрешенный белок); оказалось, что ферменты LUCA имеют максимум активности при температурах примерно 60 или 70 °C. То есть LUCA жил там, где было весьма-весьма тепло. Он был термофилом, хотя и не гипертермофилом — жил все-таки не в кипятке. Но при температурах 60–70 °C аспарагин и глутамин уже могут вызвать проблемы.
Я более-менее рассказал, хотя и очень кратко, как мог возникнуть белковый синтез. Думаю, что у вас накопились вопросы, на которые я попробую ответить, а потом я бы еще сказал немножко про место этого моего рассказа в том, что вам могут рассказать другие спикеры и что можно прочитать в научной и научно-популярной литературе.
— Вы рассказали, как это всё и в какой последовательности формировалось. Я спрашиваю: зачем? Здесь нужна была какая-то очень сильная мотивировка для того, чтобы такая сложная цепочка прошла отбор, чтобы она была очень полезной… Понятно, в чем заключалась польза первых заряженных пептидов — сворачивание РНК и его большая свобода форм. А вот дальнейшие усложнения: белки, сложные белки… Что они дали?
— Смотрите, тут, конечно, однозначного ответа ни у меня, ни у кого нет, но, по-моему, не будет большой натяжкой считать, что естественный отбор мог поддерживать и достаточно маленькие шаги на этом пути, например, для работы рибозимы РНК-полимеразы. Те рибозимы с такой функцией, которую пытались получить, работают довольно плохо и медленно, сильно уступая белковым РНК-полимеразам. И тут на самом деле есть фундаментальное ограничение (даже два), почему они так делают.
Во-первых, та химическая реакция, которая нужна для создания новой связи между нуклеотидами, — это развернутая в обратную сторону реакция гидролиза, реакция разрушения РНК. И если в активном центре находится катализатор этой реакции в сторону синтеза новых цепочек РНК, значит, он же (ведь катализаторы не сдвигают химическое равновесие, а только ускоряют его достижение) будет катализировать и распад РНК. А какая РНК всегда рядом с активным центром? Сам рибозим. То есть слишком хороший рибозим-РНК-полимераза, скорее всего, будет опасен для самого себя. Обратите внимание, что синтез белков происходит под контролем рибозима, даже сейчас. Пептидилтрансферазный центр — это рибозим. И аналогично можно предположить, что синтез РНК довольно рано происходил под контролем белков, потому что реакция вот этого образования связи или гидролиза связи между нуклеотидами безопасна для белкового остова. Для разрушения белков нужны другие катализаторы.
Второе соображение. Почему рибозимы РНК-полимеразы работают плохо и медленно? Потому что и РНК-матрица, с которой они работают, и сам рибозим представляют собой цепочки РНК. Если в РНК-матрице будут участки, комплементарные участкам рибозима, то они просто образуют с ними коротенький двуспиральный участок и прилипнут, заклинив. Можно ли этого избежать? До конца нет, потому что для мира РНК вот этот рибозим РНК-полимераза должен копировать в том числе сам себя. А когда он будет копировать сам себя, то неизбежно возникнут участки, комплементарные самому себе. А белок не образует таких комплементарных взаимодействий с РНК и от подобных недостатков может быть свободен.
Если посмотреть в активный центр белковых РНК-полимераз, там можно увидеть, как правило, три остатка аспартата, между которыми держатся два иона магния, которые и проводят, собственно, химическую реакцию. И три остатка аспартата часто находятся на одном кусочке пептидной цепочки, в последовательности чего-то типа аспартат-глицин-аспартат-валин-аспартат. И вот такое можно синтезировать тоже без генетического кода, используя механизмы синтеза периодических пептидов силами проторибосомы без малой субъединицы. Вот такие периодические пептиды с аспартатом для активного центра рибозима и РНК-полимеразы могли быть следующим полезным продуктом проторибосом.
Ну и когда уже пошло появление белков, способных свернуться самостоятельно, каждый шаг на этом пути мог быть поддержан сразу по нескольким причинам. Во-первых, белки, в принципе, химически более стабильны, чем РНК, особенно в щелочной среде, в присутствии солей железа и т. д. Переживание каких-то химически неблагоприятных условий для мира РНК плюс белков более просто, чем для мира РНК. Во-вторых, белки с их химическим разнообразием могли быть включены в какие-то начальные стадии гонки вооружений. Гонка вооружений — это известный эволюционный механизм, который может обеспечивать очень быстрые изменения. Все современные организмы находятся в состоянии гонки вооружений по направлению паразит — хозяин. На всех клеточных формах жизни паразитируют те или иные вирусы. И поэтому всё время среди клеток есть отбор на устойчивость к вирусам, а среди вирусов есть отбор на способность к заражению клеток хозяев. И этот отбор не прекращается никогда. Все четыре с лишним миллиарда лет, что жизнь на Земле существует, этот отбор шел и производил множество эволюционных новшеств.
И в мире РНК, скорее всего, с самых ранних этапов был в том или ином виде паразитизм. Какие-то первые паразиты могли быть похожи на современные вироиды — паразиты РНК-вирусов. Белки, распознающие такие вироиды или кодируемые самими вироидами, могли быть оружием в этой гонке вооружений. Преимущество белков тут в том, что их нельзя разрушить теми рибозимами, которые разрушают другие РНК. Белки неуязвимы к нуклеазам. Такая неуязвимость, естественно, очень полезна для средства, применяемого в гонке вооружений.
Кто первый это применил — паразит или хозяин, — мы уже не узнаем, но из-за того, что геномы тогда, наверное, были маленькими, а для рибосомы с ее обслуживающей всей периферией нужно много информации, все-таки это, вероятно, было новшество хозяев, однако сделанное под давлением паразитов. И дальше такая гонка вооружений могла поддерживать включение каждой новой аминокислоты в аминокислотный набор вплоть до современных 20. Я бы смотрел в эту сторону.
Всё, что я сегодня говорил, довольно сильно расходится, например, с тем, что вы можете прочитать в книге Евгения Кунина «Логика случая». Там он, оценивая вероятность появления жизни, считает, что самым сложным и маловероятным шагом было случайное возникновение рибосомы. То есть он не берет для рибосомы путь смены функций, путь постепенной дарвиновской эволюции из более простых предшественников, а считает, что рибосома возникла случайной самосборкой более-менее сразу, более-менее в современном размере и сложности.
— Он смягчил свой подход. В предыдущем интервью в «Троицком варианте» он уже гораздо мягче высказался…
— То есть там это у Евгения было одним из аргументов в пользу того, что наша жизнь единственная в обозримой Вселенной. Потому что вероятность ее возникновения получалась примерно сравнимой с количеством звезд в видимых галактиках. Но раз он смягчил с тех пор свой подход — ну что ж, хорошо, что я теперь не так сильно ему противоречу. Но мне как эволюционному биологу (а по первому образованию вообще зоологу) случайная самосборка таких довольно сложных структур, конечно, интуитивно не нравится, хочется поискать какой-то эволюционный путь. И для очень многих сложных структур эволюционные биологи такие пути на самом деле нашли — начиная с развития глаза, которое припоминали еще Дарвину, до каких-то сложных молекулярных машин.
— Ну вот на этом давайте это сложное, на самом деле, интервью завершим. Оно, безусловно, будет не последнее, значит, это всё надо будет развивать и проговаривать немножко под другим углом зрения. На этом, Михаил, огромное спасибо за очередное интервью — и спасибо слушателям.
— До свидания!
1 trv-science.ru/2023/11/replikatory-mesto-zhizni-vo-vselennoj
2 trv-science.ru/2023/12/proishozhdenie-zhizni-nefermentativnaya-replikacziya
3 Альтштейн А.Д. (1987) Происхождение генетической системы // Молекулярная биология 21: 309–322.

 (4 оценок, среднее: 4,75 из 5)
(4 оценок, среднее: 4,75 из 5)
Непонятно, но интересно. Всё-таки есть ощущение, что вот про этот “рибозим РНК-полимераза” как-то было недостаточно разжёвано.
Например:
“Если в РНК-матрице будут участки, комплементарные участкам рибозима, то они просто образуют с ними коротенький двуспиральный участок и прилипнут, заклинив. Можно ли этого избежать? До конца нет, потому что для мира РНК вот этот рибозим РНК-полимераза должен копировать в том числе сам себя. А когда он будет копировать сам себя, то неизбежно возникнут участки, комплементарные самому себе.”
Надо ли это понимать так, что он вообще не может работать, т.е. безбелковый РНК-мир (“плавают где-то там в каком-то растворе — совершенном РНК-мире — совершенные молекулы РНК, которые великолепно умеют размножаться и отлично проходят отбор”) на самом деле вовсе невозможен?
Думаю нет, поскольку там нет такого механизма синтеза белков. Но я тут и сам не все понимаю
Oбьемы нефти на Земле на порядки превышают количество органических соединений, которые образовались при разрядах молний. Проделайте опыт. Накапайте 100 капель оливкового (посолнечного) масла в воду в кастрюле. Они всегда соберутся в одну! каплю. Значит первые РНК, ДНК, органические вещества могли образоваться и в огромной луже, озере из нефти в смеси с водой возле гейзеров, вулканов даже под землей. Анализировали ли нефть на содержание молекул рнк, днк?
Сегодня прислали:
https://www.nature.com/articles/d41586-024-00544-4?utm_source=Live+Audience&utm_campaign=d9ad4e8e7d-briefing-dy-20240226&utm_medium=email&utm_term=0_b27a691814-d9ad4e8e7d-51496800